 Movie
Movie 研究の紹介
当研究室では大きく分けて、
モータータンパク質の機能解明、 高速原子間力顕微鏡の開発と応用、
の2つのテーマで研究を行っています。
生体内では様々な運動が見られます。筋肉の収縮、細胞核の分裂、細胞質分裂、軸索内における物質輸送、細胞内顆粒の輸送、鞭毛や繊毛の運動などなど、運動の形態は様々です。これらの運動を起こしているのがモーター蛋白質です。現在までの知見では、以下の5つの系が存在することが分かっています。
1)Actin-Myosin系、 2)Microtubule-Kinesin系、 3)Microtubule-Dynein系、 4)Flagella-Rotary Motor系 5)Fo-F1 Rotary Motor系
4)、5)のRotary Motor系は特殊な細胞或いは細胞内器官にしか存在しませんが、1)、2)、3)の系は全ての細胞に存在すると考えられています。Actinはフィラメント状に、Tubulinはチューブ状に重合しかなり長い繊維を形成します。この繊維にMyosin、Kinesin或いはDyneinが結合し、ATPの加水分解によって得たエネルギーを使って力を発生し、仕事をします。
これらモーター蛋白質の大きさはおおよそ10nm程度しかありません。また、ATP1分子の加水分解で得られるエネルギーの大きさは20kT (T: 室温)しかありません。それにも拘わらず高いエネルギー変換効率を実現しています。どのような物理的メカニズムが働いているのでしょうか?それを解明することを目指して、様々なアプローチで研究しています。
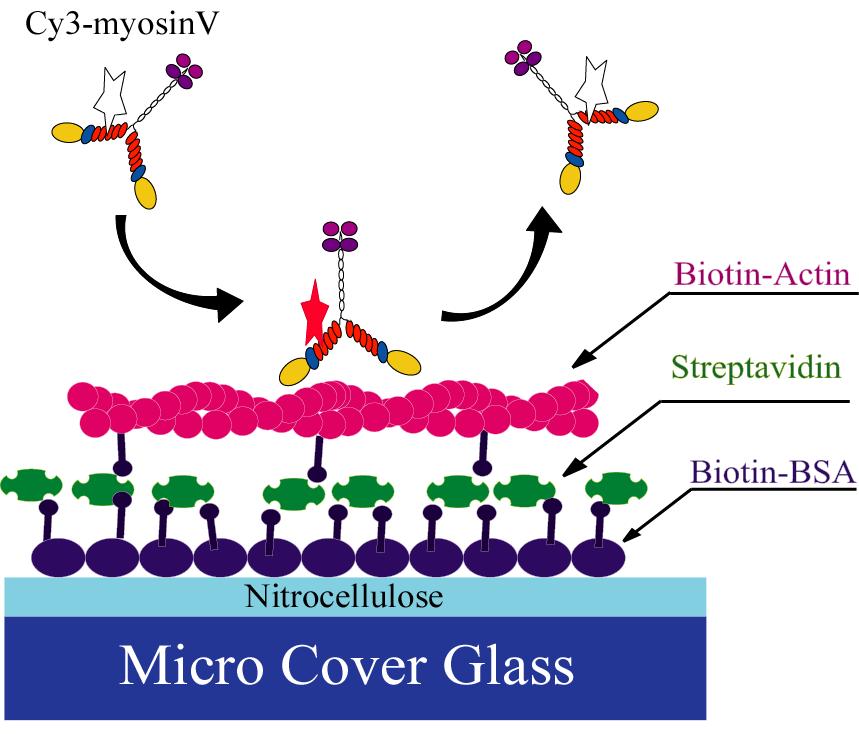
(a) MyosinV
Myosinはあらゆる細胞に存在しますが、全く同じ蛋白質ではありません。系統発生による分類により現在17クラスのミオシンが存在することが分かっています。それらのうち、クラスVは細胞内で運搬役として働いていることがいくつかの研究室で既に調べられています。最近当研究室で、ひよこの脳から抽出精製したMyosinVが1分子でアクチンフィラメント上を連続的に滑ることを明らかにしました。このMyosinVの性質(プロセッシビティ)はモーター蛋白質のエネルギー変換機構の研究にとても役に立つはずです。運動している様子とATPを加水分解している様子を1分子レベルで同時観察することが可能ですので、分解と運動のタイミング、1ATP当たりの運動距離などを計測できるに違いありません。これらの情報はエネルギー変換の基本的ルールを与えることになる
当研究室では最近高速原子間力顕微鏡を開発しました。これを使えば水溶液中で機能を営んでいるMyosinVのナノメーター世界を映像として捉えることができそうです。電子顕微鏡で撮った静止画像を適当に並べて動画像を作った研究者がいますが、そのようなものを真実であるかのように発表するのは正しいとは思われません。動的振る舞いを直接見ることが大事です。
(b) Myosin II
17クラスあるミオシンの内でMyosin IIは最も古くから研究されています。Myosin IIは筋肉に多く存在します。いろいろな種類の筋肉がありますが、それらには種類の異なるMyosin IIが存在します。筋肉の種類によってその短縮速度や発生張力の大きさは異なります。筋肉から抽出・精製したActin、Myosin IIを使って光学顕微鏡下で運動を観察することができます。カバーガラスに固定されたMyosin IIの上を蛍光染色したActin filamentsが滑る様子を観察できます(in vitro motility assay)。このアッセイを使うと溶液条件を自由に変えることができます。同一のMyosin II、Actinでも条件を変えるとActin Filamentsの運動速度は変わります。運動速度や発生張力の大きさがどのような仕組みで変わるのかについては40年以上にわたる長い論争があります。すなわち、ATPの加水分解反応と運動・力発生という力学的な現象とがどのように結びついているのかという基本的な問題です。最近、私たちの研究室でこの問題に対する見事な答えを見出すことができました。
滑り運動速度、発生張力、最大ATP分解速度、最大ATP分解速度の半分を与えるActin濃度(Km)の間には極めてシンプルな定量的な関係が存在することが明らかになりました。単純に考えると、運動速度も発生張力も最大ATP分解速度に比例するように思われますが、そうではありませんでした。最大ATP分解速度の1/2乗に比例するのです。他方、KmはActinとMyosin IIとの親和性の逆数を表す量ですが、滑り速度はKmの1/2乗に比例し、逆に発生張力はKmの1/2乗の逆数に比例します。これら単純な定量的関係は私たちのデータばかりでなく、世界のいくつかの研究室から出されたデータと見事に一致しました。この定量的な関係は、或るモデルに基づいて得られたものですが、その詳細は論文(Biophys. J. 80 379-397 (2001))を見て下さい。
この研究では未だやり残している問題があります。上記定量関係は滑り運動に対して負荷が比較的少ないところで成り立ちますが、負荷が大きくなって運動速度が最大速度の1/3以下になるようなところでは成立しません。負荷が大きくなるとATP分解のキネティクスが変わってしまうようです。このことをどのようにモデルに組み入れるかは今後の問題ですが、負荷に依存してキネティクスがどのように変わるかを実験的に調べることも重要です。これに関するデータは、実験が難しいためほとんどありません。
原子間力顕微鏡(AFM)の基本原理はとても簡単です。先端の尖った探針が柔らかいレバーの端についたものをCantilever(片持ち梁)といいます。試料を吸着させた基板をXY走査します。このとき、探針を試料に接触させておくと、レバーは試料の凹凸に応じて撓みます。この撓みを光テコという方法で検出します。走査各点での撓み量をZ軸に、走査位置をXY軸にとると、試料の形状が再現されます。
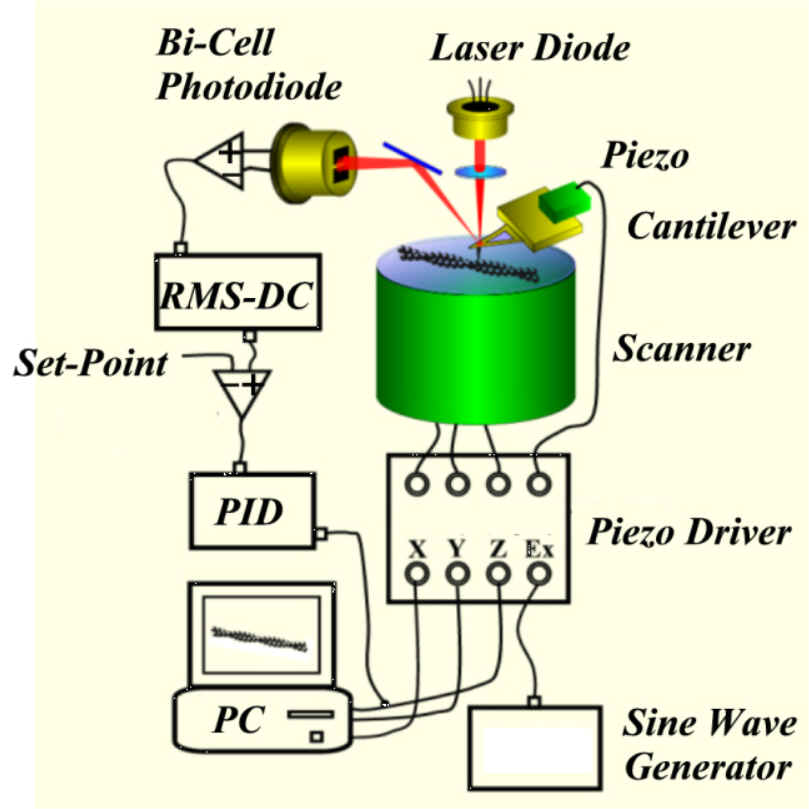
しかしこの方法ですと、レバーと試料との間にかかる力は試料の凹凸に応じて異なります。柔らかい試料には向きません。この力を一定にするように試料ステージを上下に移動させる方法(コンスタントフォースモード)が考案されました。この移動量(フィードバック量)は試料の凹凸情報をもつことになります。これら走査方法の弱点は探針が試料を横方向押してしまう点にあります。この弱点を克服する方法が考案されました。一般にACモード或いはタッピングモードと呼ばれる走査方法です。カンチレバーをその共振周波数付近で振動させると、その振幅は探針と試料が接触すると減少します。減少の大きさは接触の強さに比例します。そこで振幅が一定になるようにZピエゾにフィードバックをかければ、フィードバック量は試料の凹凸を表します。
上述したAFMの原理からも分かる通り、この顕微鏡は試料環境を選びません。真空中でも、大気中でも、液中でも構いません。空間分解能は探針先端の太さ、及び試料・探針間の接触の強さ(試料の柔らかさ)で決まりますが、生物試料でもナノメーターの空間分解能が可能です。水溶液中にある試料のナノメーター世界が観察できるわけですから、AFMは生命科学にとって大変貴重な顕微鏡と言えるでしょう。
(a) 高速AFMの開発
水溶液に在る生きた生物試料(蛋白質、DNAなど)が高い空間分解能で見えるようになると、更なる欲求が生まれてきます。生物試料が機能しているときのうごめく様子を映像として見たいという欲求です。しかし、市販のAFMも研究者が作ったAFMも走査速度が遅く、1画像を撮るだけでも分のオーダーの時間がかかってしまいます。これでは極めてゆっくりとした現象しか見ることが出来ません。我々の夢を実現するためには、走査速度を飛躍的に上げる必要があります。このための研究を当研究室では7年前に開始しました。この7年間の努力で、2002年12月現在で、1画像を0.08秒で撮れるまでになりました。連続したイメージングにより、映画を撮ることができます。
この開発では様々な要素デバイスを高速対応にしなければなりません。ひとつでも対応できないものがあれば、それで速度の上限が決まってしまいます。カンチレバー、変位検出光学系、スキャナー、ピエゾドライブ電源、センサーアンプなどひとつひとつ開発していきました。最も苦労したのはピエゾを駆動素子にもつスキャナーの部分でした。1グラム程度でmmオーダーのサイズをもった物体を望む量だけ正確に且つ高速に動かすことは一見簡単そうですが、実際にはとても難しいことです。どんな構造物も共振周波数をもちます。一旦共振するとその振動は直ぐには止まりません。定石は共振周波数を出来るだけ上げることです。その共振周波数より低い周波数で駆動すれば、共振は起こらないからです。AFMの高速化はスキャナーに100kHz以上の共振周波数を要求しましたが、それは不可能でした。色々と試作を重ねた末に、素晴らしい妙案が浮かびました。ピエゾを急激に動かしてもその支持部に撃力が及ばないようにすればよいのです。駆動用ピエゾと反対側に同種のピエゾを付け、駆動用ピエゾと同じだけ反対向きに動かすことで問題は解決しました。ピエゾ素子の固有振動数(400kHz)近くまで高速に動かすことが可能になりました。
この装置を使ってこれからいくつかの興味ある蛋白質系(Myosin V、分子シャペロン、F0-F1 ATP合成酵素など)の機能動態を撮影していきます。また同時に、装置を更に高速化することも計画しています。10フレーム/秒の速度をねらっています。近い将来蛋白質が水中で働いているありさまを目にすることができるようになるでしょう。憶測するしかなかった蛋白質の振る舞いの直視は、その機能発現メカニズムの解明に大いに役立つに違いありません。
(b) 蛋白質表面の物性マッピング
蛋白質表面には疎水性領域、親水性領域、電荷をもつ領域があります。これらは相手となる蛋白質や基質の認識、及びその機能発現に直接かかわっていることが知られています。しかし、これらの領域の存在とその局在は、アミノ酸配列、3次構造の情報からしか知ることが出来ません。また、機能中にある蛋白質表面のこれらの領域の性質が変化していくことを観察することは出来ません。或る酵素が特定の中間体をとったとき、水和水の変化が起こって疎水性の低下が起こることが実際報告されています(誘電分散法による)が、そのような蛋白質表面上で起こる変化の局在を調べることはこれまでの実験技術では出来ません。
原子間力顕微鏡はイメージング装置であると同時に精度の高いフォースセンサーでもあります。これまでのAFMの生命科学での応用では、どちらかというとイメージャーとしてよりもフォースセンサーとして利用された研究で新しい発見がなされています。例えば、基質と蛋白質との1分子結合力、蛋白質・蛋白質間の1分子結合力、蛋白質をほどくのに必要な力など、これまでの技術では難しかった測定がAFMで行われ、新しい情報を提供しています。化学種の違いを相互作用力の違いとして認識し、それをイメージングする基礎的な研究もなされています。しかし、化学的な性質が未知な試料の測定で調べられ、それが正しい答えを与えたというような研究発表は一件もありません。
私たちの研究室では、蛋白質表面の疎水性領域、荷電領域などをイメージングする試みを行ってきました。蛋白質表面から一定の距離(1-2 nm)離して探針でなぞっていき、そのときの力をイメージングすることで、蛋白質の電荷の局在や大きさを調べています。光照射で疎水性から電荷をもった親水性に変化するフォトクロミック色素を探針先端に付けて、もっと詳しく蛋白質表面の性質を調べることも行っています。この測定は通常の形状イメージングよりも時間がかかるため、機械的なドリフトの影響を受けやすい欠点があります。それ故、高速AFMはこの研究でも活躍することが期待されます。
(c) 高解像度への工夫
柔らかい試料でも真の姿をできるだけ反映した像を撮る工夫が必要です。空間分解能はカンチレバープローブ先端の曲率半径と、プローブと試料との間にかかる力の大きさに強く影響されます。先端を細くする究極的な方法は、シングルウォールのカーボンナノチューブ(CNT)をプローブにすることです。CNTをカンチレバーに付ける方法は確立していますが、とても面倒です。もっと簡便な方法を現在トライしているところです。他方、試料とプローブにかかる力を極力弱くしたいのですが、カンチレバーの共振振幅が試料・プローブ間に働く力に応じて敏感に変わらなければ、それは大変難しいことになります。水溶液中ではダンピング効果が大きく、カンチレバーの共振スペクトルはブロードになります。それ故、試料・プローブ間に働く力に対して振幅は敏感ではありません。試料・プローブ間に働く力は、距離がやや離れた所では引力(ファンデルワールス力)が働き、それより近づけると斥力が働きます。可能ならば、引力領域で画像を撮ることが理想的です。引力領域での走査を安定に保つことは難しく、ほとんど全てのAFM画像は斥力領域で撮られています。水溶液によるダンピングを見かけ上なくす方法を現在開発中です。ダンピング力は速度に比例しますので、カンチレバーの速度をモニターし、それに比例する力をカンチレバー励振信号に加算する方法です。これらの改良により、柔らかい試料に触らずに高い空間分解能で画像を得ることができるようになるでしょう。