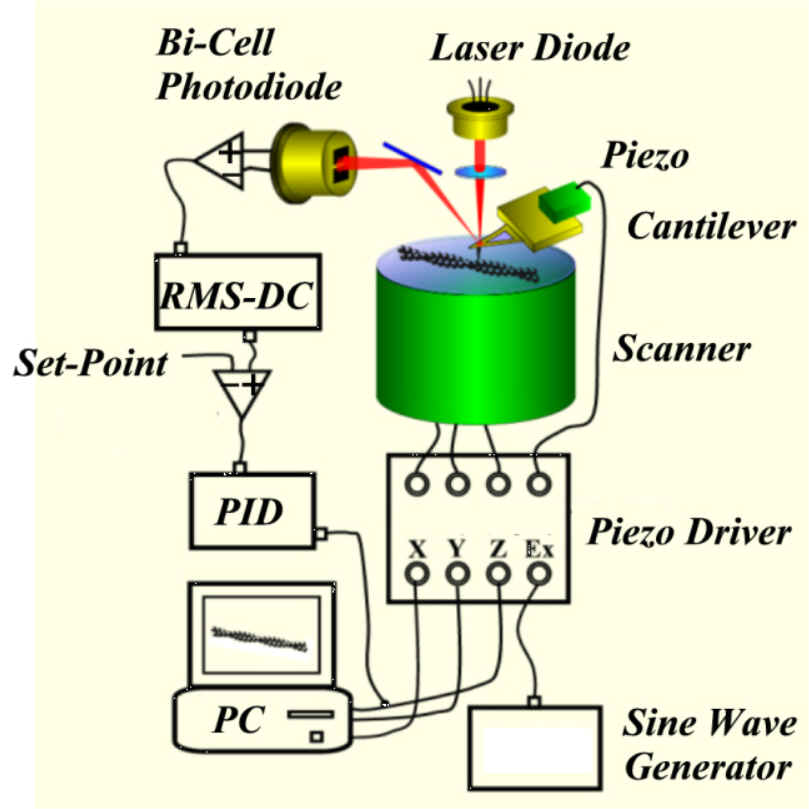
B. 原子間力顕微鏡(AFM)
原子間力顕微鏡(AFM)の基本原理はとても簡単です。先端の尖った探針が柔らかいレバーの端についたものをCantilever(片持ち梁)といいます。試料を吸着させた基板をXY走査します。このとき、探針を試料に接触させておくと、レバーは試料の凹凸に応じて撓みます。この撓みを光テコという方法で検出します。走査各点での撓み量をZ軸に、走査位置をXY軸にとると、試料の形状が再現されます。

しかしこの方法ですと、レバーと試料との間にかかる力は試料の凹凸に応じて異なります。柔らかい試料には向きません。この力を一定にするように試料ステージを上下に移動させる方法(コンスタントフォースモード)が考案されました。この移動量(フィードバック量)は試料の凹凸情報をもつことになります。これら走査方法の弱点は探針が試料を横方向押してしまう点にあります。この弱点を克服する方法が考案されました。一般にACモード或いはタッピングモードと呼ばれる走査方法です。カンチレバーをその共振周波数付近で振動させると、その振幅は探針と試料が接触すると減少します。減少の大きさは接触の強さに比例します。そこで振幅が一定になるようにZピエゾにフィードバックをかければ、フィードバック量は試料の凹凸を表します。
上述したAFMの原理からも分かる通り、この顕微鏡は試料環境を選びません。真空中でも、大気中でも、液中でも構いません。空間分解能は探針先端の太さ、及び試料・探針間の接触の強さ(試料の柔らかさ)で決まりますが、生物試料でもナノメーターの空間分解能が可能です。水溶液中にある試料のナノメーター世界が観察できるわけですから、AFMは生命科学にとって大変貴重な顕微鏡と言えるでしょう。
(a) 高速AFMの開発
水溶液に在る生きた生物試料(蛋白質、DNAなど)が高い空間分解能で見えるようになると、更なる欲求が生まれてきます。生物試料が機能しているときのうごめく様子を映像として見たいという欲求です。しかし、市販のAFMも研究者が作ったAFMも走査速度が遅く、1画像を撮るだけでも分のオーダーの時間がかかってしまいます。これでは極めてゆっくりとした現象しか見ることが出来ません。我々の夢を実現するためには、走査速度を飛躍的に上げる必要があります。このための研究を当研究室では7年前に開始しました。この7年間の努力で、20020年12月現在で、1画像を0.08秒で撮れるまでになりました。連続したイメージングにより、映画を撮ることができます。
この開発では様々な要素デバイスを高速対応にしなければなりません。ひとつでも対応できないものがあれば、それで速度の上限が決まってしまいます。カンチレバー、変位検出光学系、スキャナー、ピエゾドライブ電源、センサーアンプなどひとつひとつ開発していきました。最も苦労したのはピエゾを駆動素子にもつスキャナーの部分でした。1グラム程度でmmオーダーのサイズをもった物体を望む量だけ正確に且つ高速に動かすことは一見簡単そうですが、実際にはとても難しいことです。どんな構造物も共振周波数をもちます。一旦共振するとその振動は直ぐには止まりません。定石は共振周波数を出来るだけ上げることです。その共振周波数より低い周波数で駆動すれば、共振は起こらないからです。AFMの高速化はスキャナーに100kHz以上の共振周波数を要求しましたが、それは不可能でした。色々と試作を重ねた末に、素晴らしい妙案が浮かびました。ピエゾを急激に動かしてもその支持部に撃力が及ばないようにすればよいのです。駆動用ピエゾと反対側に同種のピエゾを付け、駆動用ピエゾと同じだけ反対向きに動かすことで問題は解決しました。ピエゾ素子の固有振動数(400kHz)近くまで高速に動かすことが可能になりました。
この装置を使ってこれからいくつかの興味ある蛋白質系(Myosin V、分子シャペロン、F0-F1 ATP合成酵素など)の機能動態を撮影していきます。また同時に、装置を更に高速化することも計画しています。10フレーム/秒の速度をねらっています。近い将来蛋白質が水中で働いているありさまを目にすることができるようになるでしょう。憶測するしかなかった蛋白質の振る舞いの直視は、その機能発現メカニズムの解明に大いに役立つに違いありません。
(b) 蛋白質表面の物性マッピング
蛋白質表面には疎水性領域、親水性領域、電荷をもつ領域があります。これらは相手となる蛋白質や基質の認識、及びその機能発現に直接かかわっていることが知られています。しかし、これらの領域の存在とその局在は、アミノ酸配列、3次構造の情報からしか知ることが出来ません。また、機能中にある蛋白質表面のこれらの領域の性質が変化していくことを観察することは出来ません。或る酵素が特定の中間体をとったとき、水和水の変化が起こって疎水性の低下が起こることが実際報告されています(誘電分散法による)が、そのような蛋白質表面上で起こる変化の局在を調べることはこれまでの実験技術では出来ません。
原子間力顕微鏡はイメージング装置であると同時に精度の高いフォースセンサーでもあります。これまでのAFMの生命科学での応用では、どちらかというとイメージャーとしてよりもフォースセンサーとして利用された研究で新しい発見がなされています。例えば、基質と蛋白質との1分子結合力、蛋白質・蛋白質間の1分子結合力、蛋白質をほどくのに必要な力など、これまでの技術では難しかった測定がAFMで行われ、新しい情報を提供しています。化学種の違いを相互作用力の違いとして認識し、それをイメージングする基礎的な研究もなされています。しかし、化学的な性質が未知な試料の測定で調べられ、それが正しい答えを与えたというような研究発表は一件もありません。
私たちの研究室では、蛋白質表面の疎水性領域、荷電領域などをイメージングする試みを行ってきました。蛋白質表面から一定の距離(1-2 nm)離して探針でなぞっていき、そのときの力をイメージングすることで、蛋白質の電荷の局在や大きさを調べています。光照射で疎水性から電荷をもった親水性に変化するフォトクロミック色素を探針先端に付けて、もっと詳しく蛋白質表面の性質を調べることも行っています。この測定は通常の形状イメージングよりも時間がかかるため、機械的なドリフトの影響を受けやすい欠点があります。それ故、高速AFMはこの研究でも活躍することが期待されます。
(c) 高解像度への工夫
柔らかい試料でも真の姿をできるだけ反映した像を撮る工夫が必要です。空間分解能はカンチレバープローブ先端の曲率半径と、プローブと試料との間にかかる力の大きさに強く影響されます。先端を細くする究極的な方法は、シングルウォールのカーボンナノチューブ(CNT)をプローブにすることです。CNTをカンチレバーに付ける方法は確立していますが、とても面倒です。もっと簡便な方法を現在トライしているところです。他方、試料とプローブにかかる力を極力弱くしたいのですが、カンチレバーの共振振幅が試料・プローブ間に働く力に応じて敏感に変わらなければ、それは大変難しいことになります。水溶液中ではダンピング効果が大きく、カンチレバーの共振スペクトルはブロードになります。それ故、試料・プローブ間に働く力に対して振幅は敏感ではありません。試料・プローブ間に働く力は、距離がやや離れた所では引力(ファンデルワールス力)が働き、それより近づけると斥力が働きます。可能ならば、引力領域で画像を撮ることが理想的です。引力領域での走査を安定に保つことは難しく、ほとんど全てのAFM画像は斥力領域で撮られています。水溶液によるダンピングを見かけ上なくす方法を現在開発中です。ダンピング力は速度に比例しますので、カンチレバーの速度をモニターし、それに比例する力をカンチレバー励振信号に加算する方法です。これらの改良により、柔らかい試料に触らずに高い空間分解能で画像を得ることができるようになるでしょう。